Standart Amino Asitlerin Sınıflandırılması
Esansiyel Amino Asitler -
Esansiyel Amino Asitler: Vücudunuzun büyümesi ve düzgün çalışması için 20 farklı amino aside ihtiyacı olduğu bilinmektedir. Bu amino asitlerin 20'sinin tümü sağlığımız için gerekli olsa da, sadece 9’u esansiyel amino asit olarak sınıflandırılmıştır (1). Bunlar;
Lösin: Protein sentezi ve kas onarımı için kritik olan bir BCAA'dır. Ayrıca kan şekeri regülasyonuna yardımcı olur, yara iyileşmesini hızlandırır ve büyüme hormonlarının üretimini teşvik eder (2).
Valin: Dallı zincirli amino asitlerden (BCAA) biridir. Kas büyümesini ve yenilenmesini teşvik etmeye yardımcı olur ve enerji üretiminde görev alır (3).
İzolösin: Kas metabolizmasında yer alan BCAA grubu amino asitlerde biridir. Bağışıklık fonksiyonu, hemoglobin üretimi ve enerji regülasyonu için kritik öneme sahiptir (4).
Fenilalalin: Vücudumuz bu amino asidi nörotransmiterlere (tirozin, dopamin, epinefrin ve norepinefrin) dönüştürür. Aynı zamanda, proteinlerin ve enzimlerin yapı ve fonksiyonunda kritik rol oynarlar. Dahası diğer amino asitlerin üretimine de katılırlar (5).
Treonin: Cilt ve bağ dokunun önemli bileşenleri olan kolajen ve elastin gibi yapısal proteinlerin temel yapı taşıdır. Ayrıca yağ metabolizması ve bağışıklık fonksiyonlarına katkı sağlar (6).
Triptofan: İştah, uyku ve ruh halini düzenleyen bir nörotransmitter olan serotoninin öncülü olarak görev yapar (7).
Histidin: Bağışıklık yanıtı opitmizasyonu, sindirim regülasyonu, cinsel işlev ve uyku-uyanıklık döngüleri için hayati önem taşıyan bir nörotransmitter olan histamin üretmek için kritik öneme sahiptir. Sinir hücrelerini çevreleyen koruyucu miyelin kılıfın korunması için görev yapar (8).
Lizin: Protein sentezinde, kalsiyum emiliminde, hormon ve enzimlerin üretiminde görev alır. Ayrıca, enerji üretimi, bağışıklık fonksiyonu, kolajen ve elastin üretimi için de kritik öneme sahiptir (9).
Metiyonin: Metabolizma ve detoksifikasyon süreçlerinde kritik rol oynar. Ayrıca doku büyümesi ve sağlığımız için hayati önem taşıyan minerallerden çinko ve selenyumun emilimi için de gereklidir (10).
Vücudumuz esansiyel olmayan amino asitleri üretebilme yeteneğine sahip olmasına rağmen, esansiyel amino asitleri üretme potansiyeli yoktur. Bu nedenle, esansiyel amino asitleri diyetinizde almalısınız. Esansiyel amino asitlerin en iyi doğal kaynakları et, yumurta ve kümes hayvanları gibi hayvansal proteinlerdir. Bununla birlikte, soya ürünleri edamame ve tofu gibi bazı bitki bazlı gıdalar, dokuz temel amino asidin tamamını içerirler. Bu gıdalara, "tam protein” kaynakları denilmektedir (11,12). Beslenme rutininde tam proteinlere yer vermek hem sağlığı korumak ve sürdürmek hem de performans gelişimi için son derece kritiktir.
Durumluk (Şartlı) Esansiyel Amino Asitler: Bazı esansiyel olmayan amino asitler, durumluk veya şartlı esansiyel amino asit olarak sınıflandırılırlar. Durumluk veya şartlı amino asitler yalnızca hastalık, hamilelik, bebeklik veya travma gibi belirli koşullar altında esansiyel amino asit olarak kabul edilirler. Durumluk (Şartlı) Amino Asitler; arjinin, sistein, glisin, glutamin, prolin, trozin, asparagin, serin’dir. Konuya örnek verecek olursak, örneğin, arjinin esansiyel olmayan amino asitlerdendir. Ancak, ciddi bir yaralanma sonrası iyileşme sürecinde veya kanser gibi belirli hastalıklarla savaşırken vücudumuz ihtiyaç duyduğumuz ölçüde arjinin üretemez. Bundan dolayı, bu gibi durumlarda artan ihtiyaç fazlasını karşılamak için arjinin dışarıdan alınması gereken durumluk (şartlı) esansiyel amino asit olarak kabul edilir. Ve dışarıdan gıda takviyesi olarak alımı önerilmektedir (13). Başka bir örnek verecek olursak, hamilelik sırasında annenin ve fetüsün sağlığını desteklemek için glisin ve arjinin gibi amino asitlere daha fazla ihtiyaç duyulmaktadır. Bu nedenle, hamilelik dönemlerinde bazı esansiyel olmayan amino asitler durumluk veya şartlı esansiyel amino asit olarak değerlendirilirler (14,15).
Prof.Dr. M.Emin KAFKAS
Hardline Academy Başkanı
Amino Asitlerin Tanımı
Amino asitler olarak bilinen nötr bileşikler grubu, kimyasal olarak diğer tüm doğal bileşiklerden esas olarak amfolitik özellikleri nedeniyle ve biyokimyasal olarak esas olarak protein bileşenleri oldukları için ayrılır. Bir amino asit, karboksil grubu ile aynı konumda bir alifatik birincil amonyum grubu içeren bir karboksilik asittir. Aynı zamanda kendine özgü bir stereokimyaya sahiptir. Proteinlerin biyosentezi, sıkı genetik kontrole tabi olan 20 amino asit kullanılarak yapılır. Amino asitler proteinin temel birimidir. Doğada 300'den fazla amino asit bulunur, ancak genler tarafından kodlandıklarından proteinlerde sadece 20'si bulunur. Protein olmayan amino asit olarak da bilinen değiştirilmiş amino asitler, diğer amino asitlerdir. Bazı amino asitler, bir protein post-translasyonel modifikasyon kullanılarak sentezlendikten sonra modifiye edilmiş kalıntılardır; diğerleri canlı organizmalarda bulunan ancak proteinlerin bileşenleri olarak bulunmayan amino asitlerdir.
Amino asitlerin özellikleri
Amino asitlerin fiziksel özellikleri
- Çözünürlük: Amino asitlerin çoğu suda çözünür, ancak organik çözücülerde çözünmez.
- Erime noktaları: Amino asit daha yüksek sıcaklıklarda, genellikle 200°C'nin üzerinde erir.
- Damak zevki: Amino asitler tatlı (Gly, Ala, Val), tatsız (Leu) veya acı (Arg, Ile) olabilir. Monosodyum glutamat veya ajinomoto, gıda endüstrisinde aroma maddesi olarak kullanılır. Çin yemeklerinin tadını ve lezzetini arttırmak için de kullanılabilir. Çin restoranı sendromu, MSG'ye duyarlı olmayan bazı kişilerde görülebilen kısa süreli grip benzeri bir durumdur.
- Optik özellikler: Glisin dışındaki tüm amino asitler, asimetrik bir karbonun varlığından dolayı optik izomerlere sahiptir. Bazı amino asitler ayrıca ikinci bir asimetrik karbon içerir, örneğin izolösin, treonin. L- ve D-amino asit yapısının gliseraldehitten farklı olduğu gösterilmiştir.
- Amfolitler olarak amino asitler: Amino asit hem bazik (NH2) hem de asidik (COOH) grupları içerebilir. Amfolitler, protonları bağışlayabilen veya kabul edebilen amino asitlerdir.
Kimyasal özellikler
1. Zitteriyonik özellik
Bir zwitterion molekülü, fonksiyonel gruplara sahip olan bir moleküldür. Bu gruplardan en az biri pozitif, en fazla biri negatif elektrik yüküne sahiptir. Molekülün net yükü sıfırdır. En iyi bilinen örnekler amino asitlerdir. Bir amin (bazik) ve bir karboksilik (asidik) grubu vardır. -NH2 daha güçlü bazdır. Bir zwitterion oluşturmak için -COOH'den H+ alır. Nötr zwitterion, çözeltide bulunan en yaygın amino asit biçimini ifade eder.
2. Amfoterik özellik
Amino asitler amfoterik olabilir, yani iki amin veya karboksilik grubun varlığı nedeniyle hem asit hem de baz gibi davranabilirler.
3. Ninhidrin testi
1 ml Ninhidrin solüsyonu 1 ml protein ile karıştırılıp ısıtılırsa mor renk a-amino asidin varlığını gösterecektir.
4. Ksantoproteik test
Ksantoproteik, aromatik amino asitleri (bir protein solüsyonunda triptofan, tirozin ve fenilalanin) tespit etmek için kullanılır. Nitrik asitlerle reaksiyon, çözeltinin sararmasına neden olur. Bu, nitrasyona ve amino asit zinciri içinde benzoid radikallerinin oluşumuna neden olur.
5. Sanger reaktifi ile reaksiyon
Sanger reaktifi (1,floro-2 ve 4-dinitrobenzen), soğuk koşullar altında hafif alkali ortamda peptit zincirlerinde serbest bir amino grubu ile reaksiyona girer.
6. Nitröz asit ile reaksiyon
Amino grubu, nitrojeni serbest bırakmak ve karşılık gelen hidroksili oluşturmak için nitrojen asit ile reaksiyona girer.
Amino asitlerin yapısı
Alfa-amino asit, 20 ortak amino asidin tümünün adıdır. Yaygın amino asitlerin her birinin bir karboksil, bir amino ve bir karbona bağlı bir yan zincir (R) vardır.
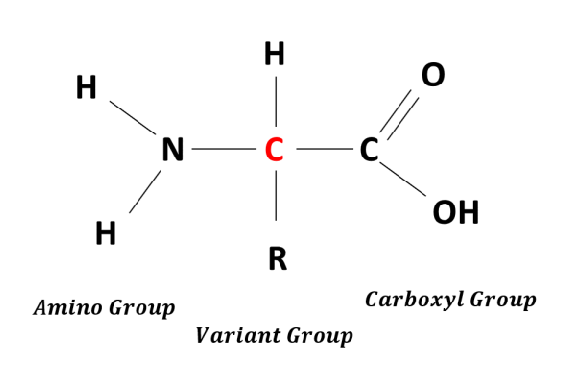
İstisnalar:
- Glisin bir yan zincir içermez. Bir karbonu iki hidrojen içerir.
- Prolin, prolini içeren nitrojen içeren bir halkadır.
- Bu nedenle her amino asidin bir ucunda bir amin, diğer ucunda bir asit ve ayrıca farklı bir yan zincir vardır. Tüm amino asitler aynı omurgaya sahiptir, ancak her amino asidin farklı bir yan zinciri vardır.
- Glisin hariç 20 amino asidin her biri L-konfigüre edilmiştir. Biri hariç tüm amino asitler asimetrik bir karbondur. Glisin, simetrik olmayan bir karbon atomu içermediğinden optik olarak aktif değildir.
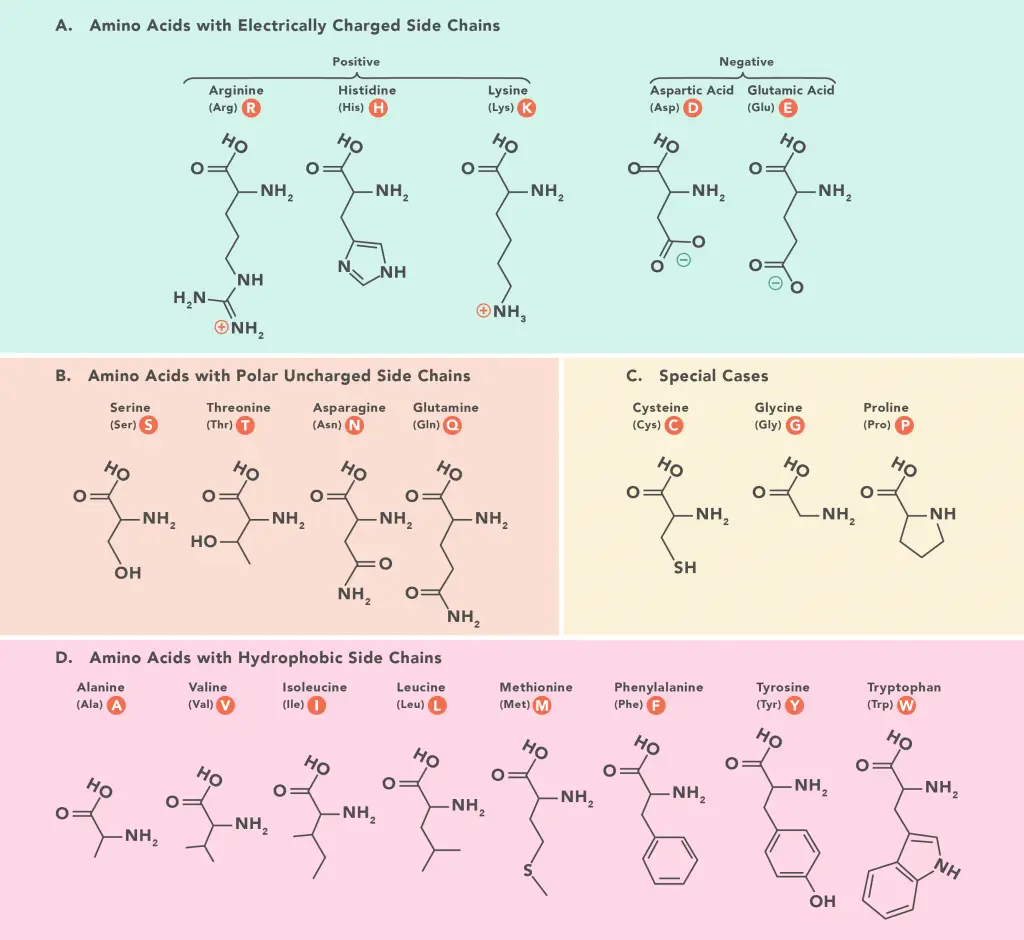
Yapısına göre amino asit sınıflandırması
Kimyasal yapılarına ve fiziksel yapılarına bağlı olarak, amino asitlerin kapsamlı bir sınıflandırması yapılabilir. Her amino aside bir sembol veya 3 harfli bir isim verilir. Bu semboller, protein yapısındaki amino asitleri temsil etmek için kullanılır. Proteinlerdeki 20 amino asitten oluşan yedi farklı grup vardır.
- Alifatik yan zincirlere sahip amino asitler: Monoamin monokarboksilik asit, alifatik yan zincire sahip bir amino asittir. Bu grup, glisin (alanin), valin, lösin, lösin ve valin gibi en temel amino asitleri içerir. Son üç amino asidin (Leu ve Val) dallı yan zincirleri, dallı zincirli amino asit dediğimiz şeydir.
- Amino asitleri içeren hidroksil grubu: Tirozin, treonin ve serin, amino asit içeren hidroksil gruplarının örnekleridir. Doğada aromatik olan tirozin, genellikle aromatik amino asitler altında kabul edilir.
- Kükürt içeren amino asitler: Bir sülfidril içeren sistein ve bir tiyoeter içeren metiyonin, protein sentezine dahil edilen amino asitlerden ikisidir. Sistin, kükürt içeren bir diğer önemli amino asittir. İki sistein molekülünün yoğunlaştırılmasıyla yapılır.
- Asidik amino asitler ve amidleri: Aspartik ve glutamik asit, dikarboksilik monoamino asit asitleridir, asparagin veya glutamin ise ilgili amid türevleridir. Bu dört amino asit, proteinlere dahil edilmelerine izin veren farklı kodonlara sahiptir.
- Temel amino asitler: Dibazik monokarboksilik asit dibazik lizin (guanidino ile) ve imidazol ile arginin (imidazol ile) üç temel amino asittir. Doğada çok temeldirler.
- Aromatik amino asitler: Fenilalanin (indol halkalı), tirozin ve triptofanın tümü aromatik amino asitlerdir. Histidin de bu kategoriye dahil edilebilir.
- İmino asitler: Eşsiz bir amino asit, pirolidin halkalarını içeren prolindir. Diğer amino asitlerde bulunan amino grubu (NH2) yerine imino (NH) içerir. Prolin bir D-imino asittir.
- Heterosiklik amino asitler: Histidin, triptofan ve prolin.
Amino asitlerin polariteye göre sınıflandırılması
Polaritelerine bağlı olarak, amino asitler dört gruba ayrılabilir. Protein yapısı için polarite çok önemlidir.
- Polar olmayan amino asitler: Hidrofobik (sudan nefret eden) olarak da bilinen bu amino asitler polar değildir. R' grubu üzerinde yükleri yoktur. Bu grup aşağıdaki amino asitleri içerir: alanin (lösin), izolösin; valin; metiyonin; fenilalanin; triptofan, prolin.
- 'R' grubunda yüksüz polar amino asitler: Bu amino asitlerin “R” grupları üzerinde hiçbir yükü yoktur. Bununla birlikte, hidroksil veya sülfhidril gibi gruplara sahiptirler ve hidrojen bağlayıcı proteinlerde yer alırlar. R = H olan glisin de bu kategoriye dahildir. Bu grup glisin (burada R = H), serin, treonin ve sisteinin yanı sıra glutamin, asparagin, tirozin ve treonin içerir.
- Pozitif 'R' grubu olan polar amino asitler: Bu grup üç amino asit histidin, arginin ve lisin içerir.
- Negatif 'R' grubuna sahip polar amino asitler: Bu grup, dikarboksilik monoamino asit-aspartik ve glutamik asitleri içerir.
Amino asitlerin beslenme sınıflandırması
Bu 20 amino asit, sentez ve diğer biyolojik işlevler için gereklidir. 20 amino asidin tamamının diyette tüketilmesi gerekli değildir. Amino asit miktarları, beslenme gereksinimlerine göre iki gruba ayrılabilir: esansiyel ve esansiyel olmayan.
1. Esansiyel veya vazgeçilmez amino asitler
Esansiyel amino asitler, vücut tarafından yapılamayan amino asitlerdir. Diyet yoluyla alınmaları gerekir. Bu amino asitler, uygun büyüme ve bakım için gereklidir. Bu on amino asit, insanlar ve fareler için hayati öneme sahiptir: Arginin (Valin), Histidin (İzolösin), Lösin, Lisin, Metiyonin, Fenilalanin, Treonin, Triptofan. [AV HILL kodu, MP. TT (her amino asitteki ilk harf), temel amino bileşiklerini hatırlamak için hatırlanabilir. H. VITTAL ve LMP de faydalı kodlardır. H. VİTTAL, LMP; PH. VILLMA, TT, PVT TIM HALL ve MATTVILPhLy.]
İki amino asit, yani histidin ve arginin, yetişkinler tarafından sentezlenebilir, ancak büyümekte olan çocuklar tarafından sentezlenemez. Bunlar yarı esansiyel amino asitlerdir (hatırlayın Ah?, hatırlamak için). 8 amino asit esastır, 2 ise isteğe bağlıdır.
2. Temel olmayan veya vazgeçilebilir amino asitler
Vücudun biyolojik ihtiyaçlarını karşılamak için yapabileceği yaklaşık 10 amino asit vardır. Diyette yenmemeleri gerekir. Bunlar arasında glisin (glisin), alanin (serin), sistein, asparagin (asparagin), glutamat, glutamin ve tirozin (prolin) bulunur.
Metabolik kaderlerine göre amino asit sınıflandırması
Amino asitlerdeki karbon iskeleti, yağ (ketojenik), glikoz (glikojenik) veya her ikisinin sentezinde öncü olarak kullanılabilir. Metabolik bakış açısı amino asitleri üç gruba ayırır.
- Glikojenik amino asitler: Bu amino asitler, glikoz ve glikojen oluşumunda öncü maddeler olarak kullanılabilir. Örneğin alanin, aspartat, glisin, metiyonin vb.
- Ketojenik amino asitler: Yağ yapmak için kullanılabilirler. Sadece iki amino asit, lizin ve lösin ketojeniktir.
- Glikojenik ve ketojenik amino asitler: Dört amino asit, izolösin (fenilalanin), triptofan ve tirozin, hem glikozun hem de yağın sentezinin öncüleridir.
Amino asitlerin sentezi
Kimyasal sentez
Mutant bakteriler genellikle ticari olarak amino asitleri üretmek için kullanılır. Sentetik ara maddelerle enzimatik dönüşümler mümkündür. 2-Aminothiazolin-4-karboksilik asit, örneğin L-sisteinin bir endüstriyel sentezinde bir ara maddedir. Amonyak fumaratın bir liyaz yoluyla fumarata eklenmesi aspartik asit üretir.
biyosentezi
Bitkilerde nitrojenin ilk formu glutamattır. Bu organik bileşik, mitokondride alfaketoglutarattan oluşur. Transaminazlar, bitkiler tarafından diğer amino asitlerin amino grubunu glutamattan başka bir alfa-ketoya aktarmak için kullanılır. Örneğin aspartat aminotransferaz, glutamatı oksaloasetata ve alfa-ketoglutaratı aspartata dönüştürür. Transaminazlar ayrıca diğer organizmalarda amino asit sentezi için kullanılır.
Standart amino asitlerde yapılan değişiklikler genellikle standart olmayan amino asitler oluşturabilir. Örneğin, homosistein, transsülfürasyon yoluyla veya metioninin ara metabolit S-adenosilmetiyonin yoluyla demetilasyonuyla oluşturulurken, hidroksiprolin, prolinin bir translasyon sonrası modifikasyonu ile yapılır.
Pek çok nadir amino asit, bitkiler ve mikroorganizmalar tarafından sentezlenir. Bazı mikroplar, sülfit köprülü alanin türevleri olan 2-aminoizobütirik ve lantionin üretir. Bu amino asitler, alametisin gibi peptidik-lantibiyotiklerde bulunabilir. [126] Bununla birlikte, bitkilerde, 1-aminosiklopropan-1-karboksilik asit, bitki hormonu etilen üretiminde bir ara madde olan, küçük bir iki ikameli siklik amino asittir.
Amino asitlerin işlevleri
- Özellikle 20 önemli amino asit, proteinlerin yanı sıra peptidleri de içerdikleri için yaşam için hayati öneme sahiptir. Ayrıca tüm canlıların yapı taşları olarak bilinirler.
- Bir proteinin üç boyutlu yapısı, yapısı tarafından belirlenir. Bir polipeptit zincirindeki amino asitlerin doğrusal dizisi ile belirlenir.
- Vücudun sağlığını ve esenliğini korumak için amino asitler gereklidir. Aşağıdakiler için gereklidir: Normal hücresel yapı, Hormon üretimi, Sinir sisteminin yapısı ve işleyişi, Hayati organların sağlığı, İnsan sinir sisteminin sağlıklı çalışması.
- Farklı dokular amino asitleri proteinleri sentezlemek veya nitrojen içeren bileşikler (örneğin pürinler, heme ve kreatin, epinefrin) yapmak ve ayrıca bunları enerji oluşturmak üzere oksitlemek için kullanır.
- Hem diyet hem de doku proteini, karbon iskeletlerinin yanı sıra nitrojen içeren substratlar üretmek için parçalanır.
- Bu nitrojen içeren substratlar, pirimidinlerin (nörotransmiterler), hormonların, hormonların, hormonal bileşiklerin, porfirinlerin ve esansiyel olmayan amino asidin biyosentezi ve sentezi için kullanılır.
- Karbon iskeletler, sitrik asit döngüsünü, glukoneogenez veya yağ asidi sentezini beslemek için kullanılabilir.
Strecker sentezinin günümüzde kullanıldığı bir örnek 3-metil-2-bütanon’dan başlayarak bir L-valin türevinin çok miktarda sentezlenmesidir [15][16]:
