7 Sınıf Periyodik Tablo
Periyodik Cetvel
Elementler benzer özelliklerine göre sınıflandırılırlar. Elementlerin benzer özelliklerine göre sınıflandırılmasıyla oluşturulan tabloya periyodik cetvel denir.
Periyodik cetvelde, elementler artan atom numaralarına göre dizilmiş ve benzer özellikteki elementler alt alta gelmiştir. Periyodik cetvele periyodik tablo ya da periyodik çizelge de denir.
- · Periyodik cetveli oluşturan yatay sıralara periyot adı verilir.
- · Yatay sıralarda atom numaraları arttıkça, elementlerin fiziksel ve kimyasal özellikleri değişir.
· Periyodik cetveldeki düşey sütunlara grup denir.
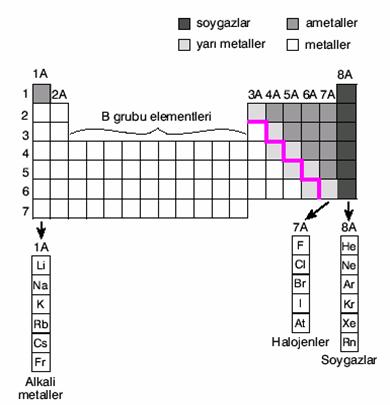
Aynı gruptaki elementler benzer kimyasal özellikler gösterir.Periyodik cetvelde 8 tane A ve 8 tane B olmak üzere 16 tane grup vardır. Periyodik cetvel 18 sütundan oluşur.
- Periyodik cetveldeki ilk sütuna 1A grubu denir.Son sütunu ise 8A grubu oluşturur.
- · grubu elementlerine alkali metaller adı verilir.
- · grubuna toprak alkali metaller denir.
- · Hidrojen grubunda olduğu hâlde alkali metaller grubuna girmez.
- · grubu elementlerine halojenler denir.
- · 8A grubu elementlerine soy gazlaradı verilir.
Grup ve Periyodun Bulunması
Bir elementin atom numarası biliniyorsa, bu elementin grup ve periyodu bulunabilir.Örneğin 7N elementinin elektronlarının dağılımı şöyledir:7N ) )
2 5 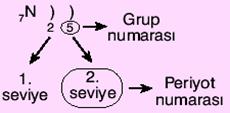
Burada en son enerji seviyesindeki elektron sayısı, grup numarasını; enerji seviyelerinin sayısı ise periyot numarasınıverir.
Bu sonuçlara göre, 7N elementi 2. periyotta grubundadır.Değerlik Elektron Sayısı
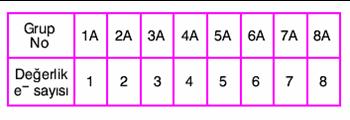
Nötr bir atomun son enerji düzeyindeki elektron sayısına, değerlik elektron sayısı denir.Gruplara göre elementlerin değerlik elektron sayıları şöyledir:
- Metallerin Genel Özellikleri
- · Periyodik çizelgenin sol tarafında bulunurlar.
- · Parlak ve serttirler.
- · Şekil verilebilirler, tel veya levha hâline gelebilirler.
- · Oda sıcaklığında katı hâlde bulunurlar. Civa (Hg) hariç.
- · Elektriği ve ısıyı iyi iletirler.
- · Bileşik oluştururken elektron verirler. Elektron verince (+) pozitif yüklü olurlar.
- · Kendi aralarında bileşik oluşturmazlar. Alaşım denilen homojen karışımlar oluştururlar.
- · Son yörüngelerinde 1,2 ve 3 elektron bulundururlar.
- · Ametallerle iyonik bağlı bileşikler oluştururlar.
- Ametallerin Genel Özellikleri
- · Periyodik çizelgenin sağ tarafında bulunurlar.
- · Mat görünüşlüdürler.
- · Vurulunca kırılabilirler, şekil verilemezler.
- · Grafit hariç elektrik ve ısıyı iyi iletmezler.
- · Oda sıcaklığında katı sıvı ve gaz hâlde bulunabilirler.
- · Metallerle yaptıkları bileşiklerde (–) negatif yüklüdürler.
- · Kendi aralarında kovalent bağlı bileşik oluşturabilirler.
- · Metallerle iyonik bağlı bileşikler oluştururlar.
- · Son yörüngelerinde 4, 5, 6 veya 7 elektron bulundururlar.
- Soy Gazlar
- · Kararlı yapıya sahiptirler.
- · Elektron alma ve verme eğilimleri yoktur.
- · Başka elementlerle bileşik oluşturmazlar.
- · Oda sıcaklığında gaz hâlde bulunurlar.
- · Periyodik çizelgenin en sağında bulunurlar.
- · Son yörüngelerinde 8 elektron bulundururlar.
- · Isı ve elektriği iyi iletmezler.
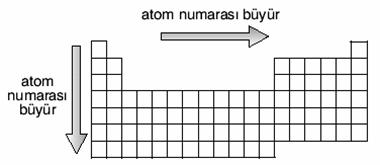
Periyodik tabloda soldan sağa gidildikçe:
Atom numarası artar. Kütle numarası artar
Elektron sayısı artar. Metalik özellik azalır
Ametallik özellik artar. Atom hacmi (çapı) azalır.
Değerlik elektron sayısı artar.
Yukarıdan aşağı inildikçe:
Atom numarası artar. Metalik özellik artar.
Elektron sayısı artar. Ametallik özellik azalır.
Atom çapı büyür. Kütle numarası artar.
Değerlik elektron sayısı değişmez.
Ders notlarım Suna gülçek fenciyim.com
0 Yorum- Yorum Yaz
Elementler listesi
Vikipedi, özgür ansiklopedi
Periyodik Tablo
| No. | Atom ağırlığı | Adı | Sembolü | Erime noktası (°C) | Kaynama noktası (°C) | Yoğunluğu (g/cm3) | Yeryüzün- deki oranı (%) | Keşif yılı | Grubu | Elektronik dizilimi | İyonizasyon enerjisi (eV) | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1,0079 | Hidrojen | H | -259 | -253 | 0,09 | 0,14 | 1776 | 1 | 1s1 | 13,5984 | |
| 2 | 4,0026 | Helyum | He | -272 | -269 | 0,18 | 1895 | 18 | 1s2 | 24,5874 | ||
| 3 | 6,941 | Lityum | Li | 180 | 1347 | 0,53 | 1817 | 1 | [He] 2s1 | 5,3917 | ||
| 4 | 9,0122 | Berilyum | Be | 1278 | 2970 | 1,85 | 1797 | 2 | [He] 2s2 | 9,3227 | ||
| 5 | 10,811 | Bor | B | 2300 | 2550 | 2,34 | 1808 | 13 | [He] 2s2 2p1 | 8,298 | ||
| 6 | 12,0107 | Karbon | C | 3500 | 4827 | 2,26 | 0,094 | eski | 14 | [He] 2s2 2p2 | 11,2603 | |
| 7 | 14,0067 | Azot | N | -210 | -196 | 1,25 | 1772 | 15 | [He] 2s2 2p3 | 14,5341 | ||
| 8 | 15,9994 | Oksijen | O | -218 | -183 | 1,43 | 46,71 | 1774 | 16 | [He] 2s2 2p4 | 13,6181 | |
| 9 | 18,9984 | Flor | F | -220 | -188 | 1,7 | 0,029 | 1886 | 17 | [He] 2s2 2p5 | 17,4228 | |
| 10 | 20,1797 | Neon | Ne | -249 | -246 | 0,9 | 1898 | 18 | [He] 2s2 2p6 | 21,5645 | ||
| 11 | 22,9897 | Sodyum | Na | 98 | 883 | 0,97 | 2,75 | 1807 | 1 | [Ne] 3s1 | 5,1391 | |
| 12 | 24,305 | Magnezyum | Mg | 639 | 1090 | 1,74 | 2,08 | 1755 | 2 | [Ne] 3s2 | 7,6462 | |
| 13 | 26,9815 | Alüminyum | Al | 660 | 2467 | 2,7 | 8,07 | 1825 | 13 | [Ne] 3s2 3p1 | 5,9858 | |
| 14 | 28,0855 | Silisyum | Si | 1410 | 2355 | 2,33 | 27,69 | 1824 | 14 | [Ne] 3s2 3p2 | 8,1517 | |
| 15 | 30,9738 | Fosfor | P | 44 | 280 | 1,82 | 0,13 | 1669 | 15 | [Ne] 3s2 3p3 | 10,4867 | |
| 16 | 32,065 | Kükürt | S | 113 | 445 | 2,07 | 0,052 | eski | 16 | [Ne] 3s2 3p4 | 10,36 | |
| 17 | 35,453 | Klor | Cl | -101 | -35 | 3,21 | 0,045 | 1774 | 17 | [Ne] 3s2 3p5 | 12,9676 | |
| 18 | 39,948 | Argon | Ar | -189 | -186 | 1,78 | 1894 | 18 | [Ne] 3s2 3p6 | 15,7596 | ||
| 19 | 39,0983 | Potasyum | K | 64 | 774 | 0,86 | 2,58 | 1807 | 1 | [Ar] 4s1 | 4,3407 | |
| 20 | 40,078 | Kalsiyum | Ca | 839 | 1484 | 1,55 | 3,65 | 1808 | 2 | [Ar] 4s2 | 6,1132 | |
| 21 | 44,9559 | Skandiyum | Sc | 1539 | 2832 | 2,99 | 1879 | 3 | [Ar] 3d1 4s2 | 6,5615 | ||
| 22 | 47,867 | Titanyum | Ti | 1660 | 3287 | 4,54 | 0,62 | 1791 | 4 | [Ar] 3d2 4s2 | 6,8281 | |
| 23 | 50,9415 | Vanadyum | V | 1890 | 3380 | 6,11 | 1830 | 5 | [Ar] 3d3 4s2 | 6,7462 | ||
| 24 | 51,9961 | Krom | Cr | 1857 | 2672 | 7,19 | 0,035 | 1797 | 6 | [Ar] 3d5 4s1 | 6,7665 | |
| 25 | 54,938 | Mangan | Mn | 1245 | 1962 | 7,43 | 0,09 | 1774 | 7 | [Ar] 3d5 4s2 | 7,434 | |
| 26 | 55,845 | Demir | Fe | 1535 | 2750 | 7,87 | 5,05 | eski | 8 | [Ar] 3d6 4s2 | 7,9024 | |
| 27 | 58,9332 | Kobalt | Co | 1495 | 2870 | 8,9 | 1735 | 9 | [Ar] 3d7 4s2 | 7,881 | ||
| 28 | 58,6934 | Nikel | Ni | 1453 | 2732 | 8,9 | 0,019 | 1751 | 10 | [Ar] 3d8 4s2 | 7,6398 | |
| 29 | 63,546 | Bakır | Cu | 1083 | 2567 | 8,96 | eski | 11 | [Ar] 3d10 4s1 | 7,7264 | ||
| 30 | 65,39 | Çinko | Zn | 420 | 907 | 7,13 | eski | 12 | [Ar] 3d10 4s2 | 9,3942 | ||
| 31 | 69,723 | Galyum | Ga | 30 | 2403 | 5,91 | 1875 | 13 | [Ar] 3d10 4s2 4p1 | 5,9993 | ||
| 32 | 72,64 | Germanyum | Ge | 937 | 2830 | 5,32 | 1886 | 14 | [Ar] 3d10 4s2 4p2 | 7,8994 | ||
| 33 | 74,9216 | Arsenik | As | 81 | 613 | 5,72 | eski | 15 | [Ar] 3d10 4s2 4p3 | 9,7886 | ||
| 34 | 78,96 | Selenyum | Se | 217 | 685 | 4,79 | 1817 | 16 | [Ar] 3d10 4s2 4p4 | 9,7524 | ||
| 35 | 79,904 | Brom | Br | -7 | 59 | 3,12 | 1826 | 17 | [Ar] 3d10 4s2 4p5 | 11,8138 | ||
| 36 | 83,8 | Kripton | Kr | -157 | -153 | 3,75 | 1898 | 18 | [Ar] 3d10 4s2 4p6 | 13,9996 | ||
| 37 | 85,4678 | Rubidyum | Rb | 39 | 688 | 1,63 | 1861 | 1 | [Kr] 5s1 | 4,1771 | ||
| 38 | 87,62 | Stronsyum | Sr | 769 | 1384 | 2,54 | 1790 | 2 | [Kr] 5s2 | 5,6949 | ||
| 39 | 88,9059 | İtriyum | Y | 1523 | 3337 | 4,47 | 1794 | 3 | [Kr] 4d1 5s2 | 6,2173 | ||
| 40 | 91,224 | Zirkonyum | Zr | 1852 | 4377 | 6,51 | 0,025 | 1789 | 4 | [Kr] 4d2 5s2 | 6,6339 | |
| 41 | 92,9064 | Niobyum | Nb | 2468 | 4927 | 8,57 | 1801 | 5 | [Kr] 4d4 5s1 | 6,7589 | ||
| 42 | 95,94 | Molibden | Mo | 2617 | 4612 | 10,22 | 1781 | 6 | [Kr] 4d5 5s1 | 7,0924 | ||
| 43 | * | 98 | Teknetyum | Tc | 2200 | 4877 | 11,5 | 1937 | 7 | [Kr] 4d5 5s2 | 7,28 | |
| 44 | 101,07 | Rutenyum | Ru | 2250 | 3900 | 12,37 | 1844 | 8 | [Kr] 4d7 5s1 | 7,3605 | ||
| 45 | 102,9055 | Rodyum | Rh | 1966 | 3727 | 12,41 | 1803 | 9 | [Kr] 4d8 5s1 | 7,4589 | ||
| 46 | 106,42 | Paladyum | Pd | 1552 | 2927 | 12,02 | 1803 | 10 | [Kr] 4d10 | 8,3369 | ||
| 47 | 107,8682 | Gümüş | Ag | 962 | 2212 | 10,5 | eski | 11 | [Kr] 4d10 5s1 | 7,5762 | ||
| 48 | 112,411 | Kadmiyum | Cd | 321 | 765 | 8,65 | 1817 | 12 | [Kr] 4d10 5s2 | 8,9938 | ||
| 49 | 114,818 | İndiyum | In | 157 | 2000 | 7,31 | 1863 | 13 | [Kr] 4d10 5s2 5p1 | 5,7864 | ||
| 50 | 118,71 | Kalay | Sn | 232 | 2270 | 7,31 | eski | 14 | [Kr] 4d10 5s2 5p2 | 7,3439 | ||
| 51 | 121,76 | Antimon | Sb | 630 | 1750 | 6,68 | eski | 15 | [Kr] 4d10 5s2 5p3 | 8,6084 | ||
| 52 | 127,6 | Tellür | Te | 449 | 990 | 6,24 | 1783 | 16 | [Kr] 4d10 5s2 5p4 | 9,0096 | ||
| 53 | 126,9045 | İyot | I | 114 | 184 | 4,93 | 1811 | 17 | [Kr] 4d10 5s2 5p5 | 10,4513 | ||
| 54 | 131,293 | Ksenon | Xe | -112 | -108 | 5,9 | 1898 | 18 | [Kr] 4d10 5s2 5p6 | 12,1298 | ||
| 55 | 132,9055 | Sezyum | Cs | 29 | 678 | 1,87 | 1860 | 1 | [Xe] 6s1 | 3,8939 | ||
| 56 | 137,327 | Baryum | Ba | 725 | 1140 | 3,59 | 0,05 | 1808 | 2 | [Xe] 6s2 | 5,2117 | |
| 57 | 138,9055 | Lantan | La | 920 | 3469 | 6,15 | 1839 | 3 | [Xe] 5d1 6s2 | 5,5769 | ||
| 58 | 140,116 | Seryum | Ce | 795 | 3257 | 6,77 | 1803 | 101 | [Xe] 4f1 5d1 6s2 | 5,5387 | ||
| 59 | 140,9077 | Praseodimiyum | Pr | 935 | 3127 | 6,77 | 1885 | 101 | [Xe] 4f3 6s2 | 5,473 | ||
| 60 | 144,24 | Neodimyum | Nd | 1010 | 3127 | 7,01 | 1885 | 101 | [Xe] 4f4 6s2 | 5,525 | ||
| 61 | * | 145 | Prometyum | Pm | 1100 | 3000 | 7,3 | 1945 | 101 | [Xe] 4f5 6s2 | 5,582 | |
| 62 | 150,36 | Samaryum | Sm | 1072 | 1900 | 7,52 | 1879 | 101 | [Xe] 4f6 6s2 | 5,6437 | ||
| 63 | 151,964 | Evropiyum | Eu | 822 | 1597 | 5,24 | 1901 | 101 | [Xe] 4f7 6s2 | 5,6704 | ||
| 64 | 157,25 | Gadolinyum | Gd | 1311 | 3233 | 7,9 | 1880 | 101 | [Xe] 4f7 5d1 6s2 | 6,1501 | ||
| 65 | 158,9253 | Terbiyum | Tb | 1360 | 3041 | 8,23 | 1843 | 101 | [Xe] 4f9 6s2 | 5,8638 | ||
| 66 | 162,5 | Disprozyum | Dy | 1412 | 2562 | 8,55 | 1886 | 101 | [Xe] 4f10 6s2 | 5,9389 | ||
| 67 | 164,9303 | Holmiyum | Ho | 1470 | 2720 | 8,8 | 1867 | 101 | [Xe] 4f11 6s2 | 6,0215 | ||
| 68 | 167,259 | Erbiyum | Er | 1522 | 2510 | 9,07 | 1842 | 101 | [Xe] 4f12 6s2 | 6,1077 | ||
| 69 | 168,9342 | Tulyum | Tm | 1545 | 1727 | 9,32 | 1879 | 101 | [Xe] 4f13 6s2 | 6,1843 | ||
| 70 | 173,04 | İtterbiyum | Yb | 824 | 1466 | 6,9 | 1878 | 101 | [Xe] 4f14 6s2 | 6,2542 | ||
| 71 | 174,967 | Lutesyum | Lu | 1656 | 3315 | 9,84 | 1907 | 101 | [Xe] 4f14 5d1 6s2 | 5,4259 | ||
| 72 | 178,49 | Hafniyum | Hf | 2150 | 5400 | 13,31 | 1923 | 4 | [Xe] 4f14 5d2 6s2 | 6,8251 | ||
| 73 | 180,9479 | Tantal | Ta | 2996 | 5425 | 16,65 | 1802 | 5 | [Xe] 4f14 5d3 6s2 | 7,5496 | ||
| 74 | 183,84 | Tungsten | W | 3410 | 5660 | 19,35 | 1783 | 6 | [Xe] 4f14 5d4 6s2 | 7,864 | ||
| 75 | 186,207 | Renyum | Re | 3180 | 5627 | 21,04 | 1925 | 7 | [Xe] 4f14 5d5 6s2 | 7,8335 | ||
| 76 | 190,23 | Osmiyum | Os | 3045 | 5027 | 22,6 | 1803 | 8 | [Xe] 4f14 5d6 6s2 | 8,4382 | ||
| 77 | 192,217 | Iridyum | Ir | 2410 | 4527 | 22,4 | 1803 | 9 | [Xe] 4f14 5d7 6s2 | 8,967 | ||
| 78 | 195,078 | Platin | Pt | 1772 | 3827 | 21,45 | 1735 | 10 | [Xe] 4f14 5d9 6s1 | 8,9587 | ||
| 79 | 196,9665 | Altın | Au | 1064 | 2807 | 19,32 | eski | 11 | [Xe] 4f14 5d10 6s1 | 9,2255 | ||
| 80 | 200,59 | Cıva | Hg | -39 | 357 | 13,55 | eski | 12 | [Xe] 4f14 5d10 6s2 | 10,4375 | ||
| 81 | 204,3833 | Talyum | Tl | 303 | 1457 | 11,85 | 1861 | 13 | [Xe] 4f14 5d10 6s2 6p1 | 6,1082 | ||
| 82 | 207,2 | Kurşun | Pb | 327 | 1740 | 11,35 | eski | 14 | [Xe] 4f14 5d10 6s2 6p2 | 7,4167 | ||
| 83 | 208,9804 | Bizmut | Bi | 271 | 1560 | 9,75 | eski | 15 | [Xe] 4f14 5d10 6s2 6p3 | 7,2856 | ||
| 84 | * | 209 | Polonyum | Po | 254 | 962 | 9,3 | 1898 | 16 | [Xe] 4f14 5d10 6s2 6p4 | 8,417 | |
| 85 | * | 210 | Astatin | At | 302 | 337 | 1940 | 17 | [Xe] 4f14 5d10 6s2 6p5 | 9,3 | ||
| 86 | * | 222 | Radon | Rn | -71 | -62 | 9,73 | 1900 | 18 | [Xe] 4f14 5d10 6s2 6p6 | 10,7485 | |
| 87 | * | 223 | Fransiyum | Fr | 27 | 677 | 1939 | 1 | [Rn] 7s1 | 4,0727 | ||
| 88 | * | 226 | Radyum | Ra | 700 | 1737 | 5,5 | 1898 | 2 | [Rn] 7s2 | 5,2784 | |
| 89 | * | 227 | Actinyum | Ac | 1050 | 3200 | 10,07 | 1899 | 3 | [Rn] 6d1 7s2 | 5,17 | |
| 90 | 232,0381 | Toryum | Th | 1750 | 4790 | 11,72 | 1829 | 102 | [Rn] 6d2 7s2 | 6,3067 | ||
| 91 | 231,0359 | Protaktinyum | Pa | 1568 | 15,4 | 1913 | 102 | [Rn] 5f2 6d1 7s2 | 5,89 | |||
| 92 | 238,0289 | Uranyum | U | 1132 | 3818 | 18,95 | 1789 | 102 | [Rn] 5f3 6d1 7s2 | 6,1941 | ||
| 93 | * | 237 | Neptünyum | Np | 640 | 3902 | 20,2 | 1940 | 102 | [Rn] 5f4 6d1 7s2 | 6,2657 | |
| 94 | * | 244 | Plutonyum | Pu | 640 | 3235 | 19,84 | 1940 | 102 | [Rn] 5f6 7s2 | 6,0262 | |
| 95 | * | 243 | Amerikyum | Am | 994 | 2607 | 13,67 | 1944 | 102 | [Rn] 5f7 7s2 | 5,9738 | |
| 96 | * | 247 | Kuriyum | Cm | 1340 | 13,5 | 1944 | 102 | 5,9915 | |||
| 97 | * | 247 | Berkelyum | Bk | 986 | 14,78 | 1949 | 102 | 6,1979 | |||
| 98 | * | 251 | Kaliforniyum | Cf | 900 | 15,1 | 1950 | 102 | 6,2817 | |||
| 99 | * | 252 | Aynştaynyum | Es | 860 | 1952 | 102 | 6,42 | ||||
| 100 | * | 257 | Fermiyum | Fm | 1527 | 1952 | 102 | 6,5 | ||||
| 101 | * | 258 | Mendelyum | Md | 1955 | 102 | 6,58 | |||||
| 102 | * | 259 | Nobelyum | No | 827 | 1958 | 102 | 6,65 | ||||
| 103 | * | 262 | Lavrensiyum | Lr | 1627 | 1961 | 102 | 4,9 | ||||
| 104 | * | 261 | Rutherfordium | Rf | 1964 | 4 | ||||||
| 105 | * | 262 | Dubniyum | Db | 1967 | 5 | ||||||
| 106 | * | 266 | Seaborgiyum | Sg | 1974 | 6 | ||||||
| 107 | * | 264 | Bohriyum | Bh | 1981 | 7 | ||||||
| 108 | * | 277 | Hassiyum | Hs | 1984 | 8 | ||||||
| 109 | * | 268 | Meitnerium | Mt | 1982 | 9 | ||||||
| No. | Atom ağırlığı | Adı | Sembolü | Ergime noktası (°C) | Kaynama noktası (°C) | Yoğunluğu (g/cm3) | Yeryüzün- deki oranı (%) | Keşif yılı | Grubu | Elektronik dizilimi | İyonizasyon enerjisi (eV) |
7. Sınıf Saf Maddeler Konu Anlatımı
7. sınıf konu anlatımları. 7. sınıf Saf Madde ve Karışımlar Konu Anlatımı. 7. sınıf fen bilimleri, 7. sınıf fen bilimleri konu anlatımı, 7. sınıf Saf Maddeler Konu Anlatımı işte yazımızda.
Saf Maddeler
Aynı cins atom veya moleküllerden oluşan maddelere saf madde denir. Elementler ve bileşikler saf maddelerdir.
Elementler
»Tek cins atomdan oluşan saf maddelerdir.
»Farklı elementlerin atomları birbirinden farklıdır. Elementler atomlardan ya da aynı atomların birleşmesiyle oluşmuş moleküllerden meydana gelir.
»Elementler sembollerle gösterilir.
»Fiziksel ve kimyasal yollarla başka maddelere ayrıştırılamaz.
»Hidrojen, demir ve altın elementlere örnektir.
Bileşikler
»En az iki farklı atomun birleşmesiyle oluşan saf maddelerdir.
»Bileşiği oluşturan elementler kendi özelliklerini kaybeder.
»Bileşiği oluşturan element atomları belirli oranlarda birleşir.
»Formüllerle gösterilir.
»Bileşiklerin bazıları moleküllerden oluşur.
»Su, tuz, şeker, sodyum hidroksit, hidrojen klorür, kalsiyum oksit bileşiklere örnektir.
Hidrojen ve oksijen atomları birleşerek su moleküllerini oluşturur. Su gibi moleküllerden oluşan bileşiklere moleküler yapılı bileşikler denir.
Elementlerin Sembolleri
Elementlerin hepsi aynı anda keşfedilmemiş, zamanla keşfedilen element sayısı artmıştır. Element sayısı artınca bu elementlere isim verme ihtiyacı hissedilmiş ve elementlere bazı özelliklerine göre isimler verilmiştir. Ancak zamanla keşfedilen element sayısı arttıkça bilim insanları bilimsel iletişimi kolaylaştırmak için elementleri sembollerle
göstermişlerdir.
Farklı ülkelerde farklı alfabeler kullanılmasına rağmen elementlerin sembolleri hep aynıdır. Element sembollerinin dünyanın her yerinde aynı olması dünyadaki bilgi paylaşımını ve bilimsel iletişimi kolaylaştırır. Elementler periyodik sistem (periyodik çizelge) adı verilen bir tablo ile gösterilir.
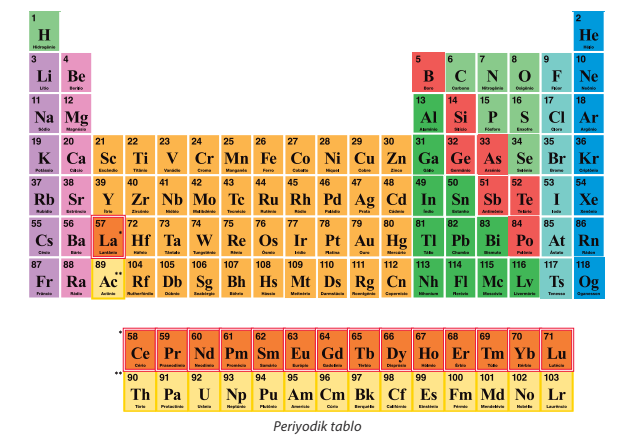
Bileşik Formülleri
Elementlerin sembollerle gösterilmesi gibi bileşiklerin formüllerle gösterilmesi de bilimsel dilde iletişim kolaylığı sağlar.
Bileşikler, bileşiği oluşturan elementlerin sembolleri ve bileşikteki birleşme oranlarını ifade eden rakamlar ile yani bileşik formülleri ile ifade edilir.
Örneğin ; su, amonyak, karbondioksit, sodyum klorür bileşik formüllerine örnek olarak verilebilir.
7. Sınıf Fen Bilimleri Konuları için tıklayınız
7. Sınıf Saf Maddeler, 7. Sınıf Saf Maddeler Konu Anlatımı, Saf Maddeler Konu Anlatımı
7. Sınıf Fen Bilimleri Elementler Ve Elementlerin Sembolleri konu anlatımı
- Genelde elementleri Yunanca veya Latince ilk harfleri ele alınarak ona göre kısaltma yapılır.
N = Azot (Nitrojen)
H = Hidrojen
C = Karbon (Carbon)
Yukarıda verdiğimiz gibi daha birçok farklı ve önemli elementler bulunmaktadır. Bu elementlerin her biri kısa harfleri üzerinden ele alınarak değerlendirilir.
Not: Eğer aynı harfle başlayan elementler var ise, o zaman bu elementlerden birinin yanına ikinci Latince ve Yunanca harf getirilir. Böylece elementler birbirlerinden ayrılır ve daha doğru şekilde okunur.
Ca = Kalsiyum (Calsium)
Elementlerin sembolleri her daim evrenseldir. Diğer bir ifade ile tüm dünyada aynı şekilde kullanılır. Bunun temel amacı ortak bilim dili oluşturmak ve bilimsel iletişimi daha kolay hale getirmektir. Ayrıca elementler ülkelere bağlı olarak uzun okunuşu ve yazılışı açısından değişkenlik gösterebilmektedir. Fakat kısaltılmış harfleri ortak şekilde dünya çapında Latince ve Yunanca isimlerinden gelir.
Periyodik Tablo: Elementlerin belirli bir kurala bağlı olarak yerleştirilmiş olduğu çizelgeye periyodik tablo denmektedir. Böylece elementlerin insan eliyle hayat bulan bazı özellikleri oluşur.
- Element numarası
- Element adı
- Element sembolü
Bu şekilde periyodik tablo içerisinde elementler sıralı biçimde yerleştirilir ve böylece daha kolay kullanım imkanı elde edilir.
Periyodik tablodaki ilk 20 element ve en çok kullanılan elementler
Periyodik tabloda ilk 20 element sırasıyla şu şekilde yer almaktadır.
1) H = Hidrojen
2) He = Helyum
3) Li = Lityum
4) Be = Berilyum
5) B = Bor
6) C = Karbon
7) N = Azot
8) O = Oksijen
9) F = Flor
10) Ne = Neon
11) Na = Sodyum
12) Mg = Magnezyum
13) Al = Alüminyum
14) Si = Silisyum
15) P = Fosfor
16) S = Kükürt
17) Cl = Klor
18) Ar = Argon
19) K = Potasyum
20) Ca = Kalsiyum
Aynı zamanda günümüzde farklı amaçlar doğrultusunda pek çok alanda en fazla kullanılan elementler ve simgeleri söz konusudur. Şimdi Bunları sırasıyla ele alalım.
- Cr = Krom
- Fe = Demir
- Co = Kobalt
- Ni = Nikel
- Cu = Bakır
- Zn = Çinko
- Ag = Gümüş
- Sn = Halay
- Au = Altın
- Hg = Civa
- Pb = Kurşun
Özelliklerine bağlı olarak tüm bu elementler günümüzde pek çok amaçla kullanılmaktadır. Özellikle hayatımızda kullandığımız farklı ürünler ile beraber aldığımız hizmetler açısından da bu elementler değerlendirilir. Hala periyodik tablo içerisindeki elementler bilim insanları tarafından laboratuvarlarda deneye sokuluyor. Bu deneyler neticesinde yeni elementler keşfedilmeye çalışılmaktadır.
Siz de dünyadaki bütün farklı element isimlerini ve simgelerini ele alarak karşılıklı şekilde yazabilirsiniz. Böylece daha hangi elementler olduğunu daha iyi biçimde anlayabilirsiniz.